公司研發團隊成功開發出全球首創之新型抗體藥物複合體TMB-365-ADC,展現出高度精準的CD4⁺免疫細胞靶向能力與顯著的抗病毒活性,為愛滋病精準治療、功能性治癒與長期安全管理提供嶄新策略。
TMB-365-ADC的核心設計源於中裕已上市藥物 Trogarzo®(ibalizumab)的長效改良版本TMB-365。
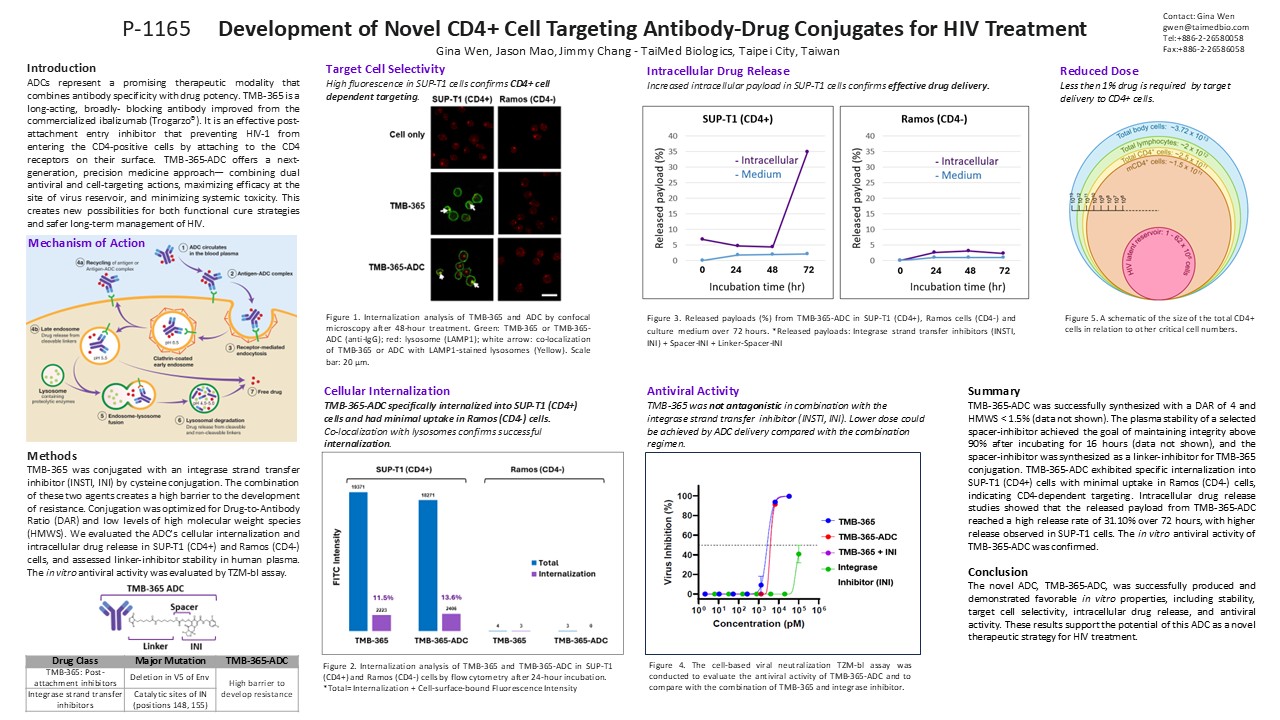
TMB-365為一具廣泛阻斷能力的長效型抗體,可抑制HIV-1進入CD4⁺免疫細胞。透過ADC技術結合嵌合酶抑制劑(INSTI)載荷藥物,TMB-365-ADC進一步強化抗藥性屏障與抗病毒療效,同時顯著降低全身性毒性,展現兼具創新與安全性的雙重優勢。
此次發表的體外驗證試驗中,TMB-365-ADC成功展現以下4大技術亮點:
- 高度靶向性:能專一性結合並內化至作為病毒潛伏溫床的CD4⁺免疫細胞中,達成精準藥物遞送。
- 有效藥物釋放:能在標靶CD4⁺免疫細胞中實現顯著的載荷釋放,於72小時內釋放率達31%,並維持持續性作用。
- 雙機制抗病毒活性:同時發揮TMB-365與嵌合酶抑制劑之抗病毒效能,形成雙機制作用,並透過精準遞送機制,有望在更低劑量下達到與傳統療法相當甚至更佳的抑制效果。
- 優異穩定性:抗體與藥物的結合比例(DAR)達最佳化DAR=4,即每個抗體結合四個藥物分子,並保持高度穩定性。
除TMB-365-ADC外,中裕新藥於長效雙抗體組合TMB-365/TMB-380的臨床開發亦持續取得重大進展。該組合於Phase 2a臨床試驗中展現優異的安全性與持久的抗病毒效果,證實僅需每八週給藥一次即可有效抑制病毒複製,並獲得臨床專家與學術界的高度肯定。正在積極推進的Phase 2b臨床試驗,規劃中的約20個臨床中心正陸續就緒,首位受試者預計將於近期正式展開治療。
美國FDA已於2024年2月7日授與TMB-365/TMB-380「快速審查認定」(Fast Track Designation),以加速審查進程。公司預期,待後續「突破性療法認定」(Breakthrough Therapy Designation, BTD)通過後,將成為臨床價值與商業化可行性的關鍵里程碑,進一步縮短新藥上市時程。
在策略合作與全球布局方面,中裕採取「同步開發、同步授權」策略,積極與多家國際藥廠展開合作洽談,涵蓋 TMB-365/TMB-380及TMB-365-ADC平台,期望與策略夥伴共同推動全球臨床試驗與商業化進程,加速實現全球市場布局。
TMB-365-ADC平台的應用潛力不僅限於HIV治療,未來亦將拓展至自體免疫疾病領域。其原理與愛滋病應用類似,透過將ADC載荷從抗病毒小分子轉換為免疫調節藥物,以精準靶向CD4⁺免疫細胞的方式,達到降低劑量、減少毒性與提升治療安全性的目的,為新一代免疫疾病治療方案奠定基礎。
全球長效型HIV藥物市場預計至2032年將超過150億美元,約佔整體HIV藥物市場(約500億美元/年)的30%以上,為TMB-365/TMB-380帶來強勁的市場動能。
根據公開市場研究報告,全球自體免疫疾病藥物市場規模預估至2032年將達四千億美元級。其中由CD4⁺免疫細胞失衡所引起的疾病可望佔約20%(約800億美元/年)的潛在市場。
中裕目標在兩年內推進TMB-365-ADC進入臨床試驗,該平台將成為公司長期發展的關鍵技術之一,並進一步鞏固中裕於國際生技領域的創新領導地位。